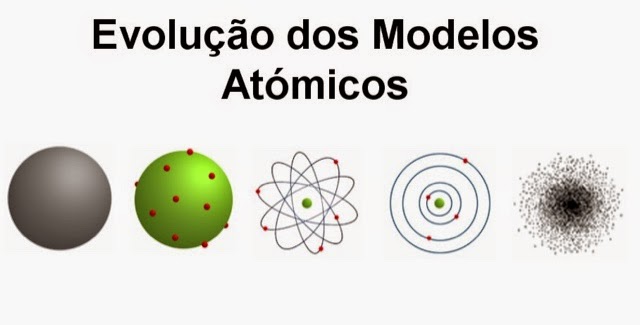
Evolução do modelo atómica
Modelo Atómica de Dalton
- John Dalton imaginava os átomos, no início do séc. XIX, como corpúsculos indivisíveis e indestrutíveis.
Modelo Atómico de Thomson
Nós finais do séc. XIX, o físico Joseph Thomson que os átomos tinham partículas com carga elétrica negativa, os electrões. Isto levou-o a imaginar que os átomos eram corpúsculos com carga positiva onde se encontravam dispersos os electrões, com carga negativa, em número suficiente para a carga global ser nula. Foi assim que surgiu o primeiro modelo de átomo divisível.
Modelo atómico de Rutherford
No início do séc. XX, Ernest Rutherford realizou uma experiência que o levou a concluir que: a maior parte do átomo seria espaço vazio e que no interior do átomo havia uma zona central muito pequena, com carga positiva, onde estaria concentrada toda a sua massa.
Isto levou o Rutherford a imaginar os átomos constituídos por um núcleo muito pequeno, com carga positiva onde se concentra toda a massa do átomo e que os electrões com carga negativa moviam-se em volta do núcleo. Surgiu assim o primeiro modelo planetário do átomo.
Modelo atómico de Bohr
Em 1913, Niels Bohr completou o modelo de Rutherford com as seguintes ideias: os electrões moviam-se à volta do núcleo em órbitas circulares, a cada órbita correspondia um determinado valor de energia e os electrões com mais energia moviam-se em órbitas mais afastadas do núcleo e os com menos energia em órbitas mais próximas do núcleo.
Modelo da Nuvem Atómica
Atualmente crê-se que os electrões movem-se livremente, formando uma nuvem que não é uniforme: a nuvem electrónica. Esta é mais densa próxima do núcleo, onde é mais provável encontrar electrões e menos densa longe do núcleo, onde é menos provável encontrar electrões.
_________________________________________________________________________





Sem comentários:
Enviar um comentário